Опыт штерна - экспериментальное подтверждение теории. Скорости газовых молекул
Во второй половине девятнадцатого века исследование броуновского (хаотичного) движения молекул вызывало острый интерес у многих физиков-теоретиков того времени. Разработанная шотландским ученым Джеймсом вещества хоть и была общепризнанной в европейских научных кругах, но существовала лишь в гипотетическом виде. Никакого практического ее подтверждения тогда не было. Движение молекул оставалось недоступным непосредственному наблюдению, а измерение их скорости казалась просто неразрешимой научной проблемой.
Именно поэтому эксперименты, способные на практике доказать сам факт молекулярного строения вещества и определить скорость движения его невидимых частиц, изначально воспринимались как фундаментальные. Решающее значение таких экспериментов для физической науки было очевидно, так как позволяло получить практическое обоснование и доказательство справедливости одной из самых прогрессивных теорий того времени - молекулярно-кинетической.
К началу двадцатого столетия мировая наука достигла достаточного уровня развития для появления реальных возможностей экспериментальной проверки теории Максвелла. Немецкий физик Отто Штерн в 1920-м году, применив метод молекулярных пучков, который был изобретен французом Луи Дюнойе в 1911-м году, сумел измерить скорость движения газовых молекул серебра. Опыт Штерна неопровержимо доказал справедливость закона Результаты этого эксперимента подтвердили верность оценки атомов, которая вытекала из гипотетических предположений, сделанных Максвеллом. Правда, о самом характере скоростной градации опыт Штерна смог дать только весьма приблизительные сведения. Более подробной информации науке пришлось ждать еще девять лет.

С большей точностью закон распределения удалось проверить Ламмерту в 1929-м году, несколько усовершенствовавшему опыт Штерна путем пропускания молекулярного пучка сквозь пару вращающихся дисков, имевших радиальные отверстия и смещенных относительно друг друга на определенный угол. Изменяя скорость вращения агрегата и угол между отверстиями, Ламмерт смог выделить из пучка отдельные молекулы, которые обладают различными скоростными показателями. Но именно опыт Штерна положил начало экспериментальным изысканиям в области молекулярно-кинетической теории.

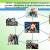
В 1920-м году была создана первая экспериментальная установка, необходимая для проведения экспериментов такого рода. Она состояла из пары цилиндров, сконструированных лично Штерном. Внутрь прибора был помещен тонкий платиновый стержень с серебряным напылением, которое и испарялось при нагревании оси электричеством. В условиях вакуума, которые были созданы внутри установки, узкий пучок атомов серебра проходил свозь продольную щель, прорезанную на поверхности цилиндров, и оседал на специальном внешнем экране. Разумеется, агрегат находился в движении, и за то время, пока атомы достигали поверхности, успевал повернуться на некоторый угол. Таким способом Штерн и определил скорость их движения.
Но это не единственное научное достижение Отто Штерна. Через год он совместно с Вальтером Герлахом провел эксперимент, подтвердивший наличие у атомов спина и доказавший факт их пространственного квантования. Опыт Штерна-Герлаха потребовал создания специальной экспериментальной установки с мощным в ее основе. Под воздействием магнитного поля, генерируемого этим мощным компонентом, отклонялись согласно ориентации их собственного магнитного спина.
Лекция 15
Молекулярная физика
Вопросы
1. Закон Максвелла распределения молекул идеального газа по скоростям и энергиям.
2. Идеальный газ в однородном поле тяготения.
Барометрическая формула. Распределение Больцмана.
3. Среднее число столкновений и средняя длина свободного пробега молекул.
4. Явления переноса в газах.
1. Закон Максвелла распределения молекул
идеального газа по скоростям и энергиям
В газе, находящемся в состоянии равновесия, устанавливается стационарное распределение молекул по скоростям, подчиняющееся закону Максвелла.
Уравнение Клаузиуса
 , (1)
, (1)
Уравнение Менделеева
– Клапейрона


 (2)
(2)





 , (3)
, (3)
т.е. средняя квадратичная скорость пропорциональна корню квадратному от абсолютной температуры газа .
Закон Максвелла описывается функцией f (v ), называемойфункцией распределения молекул по скоростям . Если разбить диапазон скоростей молекул на малые интервалы, равные dv , то на каждый интервал скорости будет приходиться некоторое число молекул dN (v ), имеющих скорость, заключенную в этом интервале. Функцияf (v ) определяет относительное число молекул dN (v )/N, скорости которых лежат в интервале отv доv+ dv , т.е.
 максвелловская
функция распределения по скоростям
максвелловская
функция распределения по скоростям
 ,
откуда
,
откуда
 .
.
Применяя методы теории вероятностей, Максвелл нашел функцию f (v ) –закон для распределения молекул идеального газа по скоростям:
 .
(4)
.
(4)

 .
(5)
.
(5)
Наиболее вероятной скоростью v в называется скорость, вблизи которой на единичный интервал скорости приходится наибольшее число молекул.
Средняя скорость
молекулы
 (средняя арифметическая скорость):
(средняя арифметическая скорость):
 (7)
(7)
Средняя квадратичная
скорость
 (8)
(8)

Из формулы (6) следует, что при повышении температуры максимум функции распределения молекул по скоростям смещается вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям растягивается и понижается.
Опыт Штерна



 .
(9)
.
(9)
2. Идеальный газ в однородном поле тяготения. Барометрическая формула. Распределение Больцмана
Если бы не было теплового движения, то все молекулы атмосферного воздуха упали бы на Землю; если бы не было тяготения, то атмосферный воздух рассеялся бы по всей Вселенной. Тяготение и тепловое движение приводят газ в состояние, при котором его концентрация и давление убывают с высотой.
Получим закон изменения давления с высотой.
Разность давлений р иp+ dp равна весу газа, заключенному в объеме цилиндра с площадью основания, равной единице, и высотой dh
p
–
(p
+
dp
)
=
g
dh
 dp
= –
g
dh
(10)
dp
= –
g
dh
(10)
Из уравнения состояния идеального газа:
 (11)
(11)
(11)
 (10)
(10)








 ,
(12)
,
(12)

где р ир 0 – давления газа на высотахh иh = 0.
Формула (12) называется барометрической . Из нее следует, что давление убывает с высотой по экспоненциальному закону.
Барометрическая формула позволяет определять высоту h с помощью барометра. Барометр, специально проградуированный, для непосредственного отсчета высоты над уровнем моря называютальтиметром . Его широко применяют в авиации, при восхождении на горы.
Обобщение барометрической формулы
 ,
так как
,
так как
 .
.








 ,
распределениеБольцмана(13)
,
распределениеБольцмана(13)
где n иn 0 – концентрации молекул на высотахh 0 иh = 0 соответственно.
Частные случаи
1.

 ,
т.е. тепловое движение стремится
разбросать частицы равномерно по всему
объему.
,
т.е. тепловое движение стремится
разбросать частицы равномерно по всему
объему.
2.

 (отсутствие теплового движения), т.е.
все частицы занимали бы состояние с
минимальной (нулевой) потенциальной
энергией (в случае поля тяготения Земли
молекулы собирались бы на поверхности
Земли).
(отсутствие теплового движения), т.е.
все частицы занимали бы состояние с
минимальной (нулевой) потенциальной
энергией (в случае поля тяготения Земли
молекулы собирались бы на поверхности
Земли).
3. Среднее число столкновений и средняя длина свободного пробега молекул
Средней длиной свободного пробега молекул называется путь, который проходит
молекула между двумя последовательными
столкновениями с другими молекулами.
называется путь, который проходит
молекула между двумя последовательными
столкновениями с другими молекулами.Эффективным диаметром молекулы d называют то наименьшее расстояние, на которое сближаются при столкновении центры двух молекул.
Лекция 5
В результате многочисленных соударений молекул газа между собой (~10 9 столкновений за 1 секунду) и со стенками сосуда, устанавливается некоторое статистическое распределение молекул по скоростям. При этом все направления векторов скоростей молекул оказываются равновероятными, а модули скоростей и их проекции на координатные оси подчиняются определенным закономерностям.
При столкновениях скорости молекул изменяются случайным образом. Может оказаться, что одна из молекул в ряде столкновений будет получать энергию от других молекул и ее энергия будет значительно больше среднего значения энергии при данной температуре. Скорость такой молекулы будет большая, но, все-таки она будет иметь конечное значение, так как максимально возможная скорость – скорость света - 3·10 8 м/с. Следовательно, скорость молекулы вообще может иметь значения от 0 до некоторой υ max . Можно утверждать, что очень большие скорости по сравнению со средними значениями, встречаются редко, также как и очень малые.
Как показывают теория и опыты распределение молекул по скоростям не случайное, а вполне определенное. Определим сколько молекул, или какая часть молекул обладает скоростями, лежащими в некотором интервале вблизи заданной скорости.
Пусть в данной массе газа содержится N молекул, при этом dN молекул обладают скоростями, заключенными в интервале от υ до υ +dυ . Очевидно, что это число молекул dN пропорционально общему числу молекул N и величине заданного интервала скорости dυ
где a - коэффициент пропорциональности.
Также очевидно, что dN зависит и от величины скорости υ , так как в одинаковых по величине интервалах, но при разных абсолютных значениях скорости число молекул будет различным (пример: сравните число живущих в возрасте 20 – 21 год и 99 – 100 лет). Это значит, что коэффициент a в формуле (1) должен быть функцией скорости.
С учетом этого перепишем (1) в виде
Из (2) получим
Функция f (υ ) называется функцией распределения. Ее физический смысл следует из формулы (3)
Следовательно, f (υ ) равна относительной доле молекул, скорости которых заключены в единичном интервале скоростей вблизи скорости υ . Более точно функция распределения имеет смысл вероятности любой молекуле газа иметь скорость, заключенную в единичном интервале вблизи скорости υ . Поэтому ее называют плотностью вероятности .
Проинтегрировав (2) по всем значениям скоростей от 0 до получим
Из (5) следует, что
Уравнение (6) называется условием нормировки функции. Оно определяет вероятность того, что молекула имеет одно из значений скорости от 0 до . Скорость молекулы имеет какое-нибудь значение: это событие достоверное и его вероятность равна единице.
Функция f (υ ) была найдена Максвеллом в 1859 году. Она была названа распределением Максвелла :
где A – коэффициент, который не зависит от скорости, m – масса молекулы, T – температура газа. Используя условие нормировки (6) можно определить коэффициент A :
Взяв этот интеграл, получим A :
С учетом коэффициента А функция распределения Максвелла имеет вид:
При возрастании υ множитель в (8) изменяется быстрее, чем растет υ 2 . Поэтому функция распределения (8) начинается в начале координат, достигает максимума при некотором значении скорости, затем уменьшается, асимптотически приближаясь к нулю (рис.1).
Рис.1. Максвелловское распределение молекул
по скоростям. T 2 > T 1
Используя кривую распределения Максвелла можно графически найти относительное число молекул, скорости которых лежат в заданном интервале скоростей от υ до dυ (рис.1, площадь заштрихованной полоски).
Очевидно, что вся площадь, находящаяся под кривой дает общее число молекул N . Из уравнения (2) с учетом (8) найдем число молекул, скорости которых лежат в интервале от υ до dυ
Из (8) также видно, что конкретный вид функции распределения зависит от рода газа (масса молекулы m ) и от температуры и не зависит от давления и объема газа.
Если изолированную систему вывести из состояния равновесия и предоставить самой себе, то через некоторый промежуток времени она вернется в состояние равновесия. Этот промежуток времени называется временем релаксации . Для различных систем он различный. Если газ находится в равновесном состоянии, то распределение молекул по скоростям не изменяется с течением времени. Скорости отдельных молекул беспрерывно изменяются, однако число молекул dN , скорости которых лежат в интервале от υ до dυ все время остается постоянным.
Максвелловское распределение молекул по скоростям всегда устанавливается, когда система приходит в состояние равновесия. Движение молекул газа хаотичное. Точное определение хаотичности тепловых движений следующее: движение молекул полностью хаотично, если скорости молекул распределены по Максвеллу . Отсюда следует, что температура определяется средней кинетической энергией именно хаотичных движений . Как бы ни велика была бы скорость сильного ветра, она не сделает его «горячим». Ветер даже самый сильный, может быть и холодным и теплым, потому что температура газа определяется не направленной скоростью ветра, а скоростью хаотического движения молекул.
Из графика функции распределения (рис.1) видно, что число молекул, скорости которых лежат в одинаковых интервалах dυ , но вблизи различных скоростей υ , больше в том случае если скорость υ приближается к скорости, которая соответствует максимуму функции f (υ ). Эта скорость υ н называется наивероятнейшей (наиболее вероятной).
Продифференцируем (8) и приравняем производную к нулю:
то последнее равенство выполняется когда:
Уравнение (10) выполняется при:
Первые два корня соответствуют минимальным значениям функции. Тогда скорость, которая соответствует максимуму функции распределения, найдем из условия:
Из последнего уравнения:
где R – универсальная газовая постоянная, μ – молярная масса.
С учетом (11) из (8) можно получить максимальное значение функции распределения
Из (11) и (12) следует, что при повышении T или при уменьшении m максимум кривой f (υ ) сдвигается вправо и становится меньше, однако площадь под кривой остается постоянной (рис.1).
Для решения многих задач удобно пользоваться распределением Максвелла в приведенном виде. Введем относительную скорость:
где υ – данная скорость, υ н – наивероятнейшая скорость. С учетом этого уравнение (9) принимает вид:
(13) – универсальное уравнение. В таком виде функция распределения не зависит ни от рода газа, ни от температуры.
Кривая f (υ ) ассиметрична. Из графика (рис.1) видно, что большая часть молекул имеет скорости большие, чем υ н . Асимметрия кривой означает, что средняя арифметическая скорость молекул не равна υ н . Средняя арифметическая скорость равна сумме скоростей всех молекул, деленная на их число:
Учтем, что согласно (2)
Подставив в (14) значение f (υ ) из (8) получим среднюю арифметическую скорость:
Средний квадрат скорости молекул получим, вычислив отношение суммы квадратов скоростей всех молекул к их числу:
После подстановки f (υ ) из (8) получим:
Из последнего выражения найдем среднюю квадратичную скорость:
Сопоставляя (11), (15) и (16) можно сделать вывод, что, и одинаково зависят от температуры и отличаются только численными значениями: (рис.2).
Рис.2. Распределение Максвелла по абсолютным значениям скоростей
Распределение Максвелла справедливо для газов находящихся в состоянии равновесия, рассматриваемое число молекул должно быть достаточно большим. Для малого числа молекул могут наблюдаться значительные отклонения от распределения Максвелла (флуктуации).
Первое опытное определение скоростей молекул провел Штерн в 1920 году. Прибор Штерна состоял из двух цилиндров разных радиусов, закрепленных на одной оси. Воздух из цилиндров был откачен до глубокого вакуума. Вдоль оси натягивалась платиновая нить, покрытая тонким слоем серебра. При пропускании по нити электрического тока она нагревалась до высокой температуры (~1200 о С), что приводило к испарению атомов серебра.
В стенке внутреннего цилиндра была сделана узкая продольная щель, через которую проходили движущиеся атомы серебра. Осаждаясь на внутренней поверхности внешнего цилиндра, они образовывали хорошо наблюдаемую тонкую полоску прямо напротив прорези.
Цилиндры начинали вращать с постоянной угловой скоростью ω. Теперь атомы, прошедшие сквозь прорезь, оседали уже не прямо напротив щели, а смещались на некоторое расстояние, так как за время их полета внешний цилиндр успевал повернуться на некоторый угол. При вращении цилиндров с постоянной скоростью, положение полоски, образованной атомами на внешнем цилиндре, смещалось на некоторое расстояние l .
В точке 1 оседают частицы, когда установка неподвижна, при вращении установки частицы оседают в точке 2.
Полученные значения скоростей подтвердили теорию Максвелла. Однако о характере распределения молекул по скоростям этот метод давал приблизительные сведения.
Более точно распределение Максвелла было проверено опытами Ламмерта, Истэрмана, Элдриджа и Коста . Эти опыты достаточно точно подтвердили теорию Максвелла.
Прямые измерения скорости атомов ртути в пучке были выполнены в 1929 году Ламмертом . Упрощенная схема этого эксперимента показана на рис. 3.
Рис.3. Схема опыта Ламмерта
1 - быстро вращающиеся диски, 2 - узкие щели, 3 - печь, 4 - коллиматор, 5 - траектория молекул, 6 – детектор
Два диска 1, насаженные на общую ось, имели радиальные прорези 2, сдвинутые друг относительно друга на угол φ . Напротив щелей находилась печь 3, в которой нагревался до высокой температуры легкоплавкий металл. Разогретые атомы металла, в данном случае ртути, вылетали из печи и с помощью коллиматора 4 направлялись в необходимом направлении. Наличие двух щелей в коллиматоре обеспечивало движение частиц между дисками по прямолинейной траектории 5. Далее атомы, прошедшие прорези в дисках, регистрировались с помощью детектора 6. Вся описанная установка помещалась в глубокий вакуум.
При вращении дисков с постоянной угловой скоростью ω, через их прорези беспрепятственно проходили только атомы, имевшие некоторую скорость υ . Для атомов, проходящих обе щели должно выполняться равенство:
где Δt 1 - время пролета молекул между дисками, Δt 2 - время поворота дисков на угол φ . Тогда:
Изменяя угловую скорость вращения дисков можно было выделять из пучка молекулы, имеющие определенную скорость υ , и по регистрируемой детектором интенсивности судить об относительном содержании их в пучке.
Таким способом удалось экспериментально проверить Максвелловский закон распределения молекул по скоростям.
1 - платиновая проволока с нанесённым на неё слоем серебра; 2 - щель, формирующая пучок атомов серебра; 3 - пластинка, на которой осаждаются атомы серебра; П и П1 - положения полосок осажденного серебра при неподвижном приборе и при вращении прибора.
Для проведения опыта Штерном был подготовлен прибор, состоящий из двух цилиндров разного радиуса, ось которых совпадала и на ней располагалась платиновая проволока с нанесённым слоем серебра . В пространстве внутри цилиндров посредством непрерывной откачки воздуха поддерживалось достаточно низкое давление . При пропускании электрического тока через проволоку достигалась температура плавления серебра, из-за чего серебро начинало испаряться и атомы серебра летели к внутренней поверхности малого цилиндра равномерно и прямолинейно со скоростью v {\displaystyle v} , определяемой температурой нагрева платиновой проволоки, то есть температурой плавления серебра. Во внутреннем цилиндре была проделана узкая щель, через которую атомы могли беспрепятственно пролетать далее. Стенки цилиндров специально охлаждались, что способствовало оседанию попадающих на них атомов. В таком состоянии на внутренней поверхности большого цилиндра образовывалась достаточно чёткая узкая полоса серебряного налёта, расположенная прямо напротив щели малого цилиндра. Затем всю систему начинали вращать с некой достаточно большой угловой скоростью ω {\displaystyle \omega } . При этом полоса налёта смещалась в сторону, противоположную направлению вращения, и теряла чёткость. Измерив смещение s {\displaystyle s} наиболее тёмной части полосы от её положения, когда система покоилась, Штерн определил время полёта, через которое нашёл скорость движения молекул:
t = s u = l v ⇒ v = u l s = ω R b i g (R b i g − R s m a l l) s {\displaystyle t={\frac {s}{u}}={\frac {l}{v}}\Rightarrow v={\frac {ul}{s}}={\frac {\omega R_{big}(R_{big}-R_{small})}{s}}} ,где s {\displaystyle s} - смещение полосы, l {\displaystyle l} - расстояние между цилиндрами, а u {\displaystyle u} - скорость движения точек внешнего цилиндра.
Найденная таким образом скорость движения атомов серебра (584 м/с) совпала со скоростью, рассчитанной по законам молекулярно-кинетической теории, а тот факт, что получившаяся полоска была размытой, свидетельствовал в пользу того, что скорости атомов различны и распределены по некоторому закону - закону распределения Максвелла : атомы, двигавшиеся быстрее, смещались относительно полосы, полученной в состоянии покоя, на меньшие расстояния, чем те, которые двигались медленнее. При этом опыт давал лишь приблизительные сведения о характере распределения Максвелла, более точное экспериментальное подтверждение относится к 1930 году (
Изучение диффузии и броуновского движения позволяет получить некоторое представление о скорости хаотического движения молекул газа. Одним из наиболее простых и наглядных опытов для ее определения является опыт О. Штерна, выполненный им в 1920 г. Сущность этого опыта заключается в следующем.
На горизонтальном столике, который может вращаться вокруг оси О (рис. 3.2), перпендикулярно столику укрепляются цилиндрические поверхности А и В. Поверхность В сплошная, а в поверхности А имеется узкий прорез, параллельный оси О. Вдоль оси О расположена вертикально платиновая посеребренная проволока, которая включается в электрическую цепь. При пропускании тока проволока накаливается и с ее поверхности происходит испарение серебра. Молекулы серебра летят во все стороны и в основном оседают на внутренней стороне цилиндрической поверхности А. Лишь узкий пучок молекул серебра пролетает сквозь щель в этой
поверхности и оседает в области М на поверхности В. Ширина налета в М определяется шириной щели в поверхности А. Чтобы молекулы серебра не рассеивались при столкновениях с молекулами воздуха, вся установка накрывается колпаком, из-под которого выкачивается воздух. Чем уже щель в поверхности А, тем уже налет в области М и тем точнее может быть определена скорость движения молекул.
Само определение скорости основано на следующей идее. Если всю установку привести во вращение вокруг оси О с постоянной угловой скоростью то за время в течение которого молекула будет лететь от щели до поверхности В, последняя успеет повернуться и налет сместится из области М в область К. Следовательно, время полета молекулы вдоль радиуса и время смещения точки М поверхности В на расстояние одинаково. Так как молекула летит равномерно, то
![]()
где - искомая скорость, - радиус цилиндрической поверхности А. Поскольку линейная скорость точек поверхности В равна юг, то время можно выразить другой формулой:
Таким образом,
![]()
Так как при выполнении опыта остаются постоянными и определяются заранее, то, измерив можно найти скорость молекулы . В опыте Штерна она оказалась близкой к 500 м/с.
Поскольку налет в области К оказывается размытым, можно заключить, что молекулы серебра летят к поверхности В с различной скоростью. Средние значения скоростей молекул математически можно выразить формулой

В качестве примера отметим, что при 0 °С средняя скорость движения молекул водорода равна 1840 м/с, а азота - 493 м/с. Изменение толщины налета в области К дает представление о распределении молекул по скоростям их движения. Получается, что небольшое число молекул имеет скорости, в несколько раз превышающие среднюю скорость.
(Подумайте, где на рис. 3.2 оставили след молекулы, скорости которых больше средней скорости и как изменится положение налета, если усилить ток в проволоке О.)